
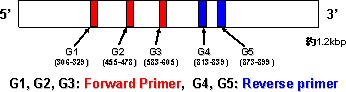
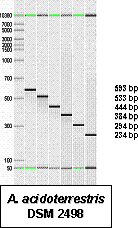
| Alicyclobacillus (アリサイクロバチルス)属細菌は、グラム陽性、好熱性( 20-70℃で生育可能:至適45-65℃)、好酸性(pH2-6で生育可能:至適pH3.5-5.0)、好気性の有胞子細菌です。土壌を主たる生息域としますが、一部の菌種( A. acidoterrestris :アシドテレストリス)が原料やラインの二次汚染から酸性飲料等に持ち込まれ、生育すると、薬品臭(グアイアコール:正露丸のような臭い)を発生するため、飲料製造上の有害菌として問題視されています。近年、この菌の検査法が(社)日本果汁協会により開発されましたが、4-12日間の増菌培養を介さなくては検出が難しいため、企業に負担を強いているのが現状です。最終鑑別法には、生育温度差に基づく方法(所要時間:20時間)とグアイアコールの検出(所要時間:3-24時間)に基づく方法がありますが、前者は人為差が生じ、後者は菌種の特定ができないのが難点です。 このような背景のもと、私たちは遺伝子による菌種の特定ができ、正確かつ時間のかからない鑑別法の開発を行ってきました。良く用いられる遺伝子は 16S rDNA(リボゾームの骨格構成に関わる遺伝子)ですが、 Alicyclobacillus 属ではこの遺伝子は誤判定を起こす場合があり、そこで私たちは gyrB 遺伝子というDNAの複製に関わる遺伝子に着目しました。いずれも生命維持に必須の遺伝子(ハウスキーピング遺伝子)ですが、16S rDNAに比べて gyrB 遺伝子は進化速度が速く(16S rDNA塩基配列の平均種間相同性:94.5%、 gyrB 遺伝子の平均相同性:77.2%)、菌種の差別化をより明確にすることができます。 まず私たちは、最も重要な管理対象菌である A. acidoterrestris (以下 AAT)について gyrB 遺伝子の塩基配列を決定し、その塩基配列が種内で非常に高度に保存されていることを示しました(99.1%以上)。次ぎに、AATに共通で、その他の菌種と異なるAAT特異領域の検索を行いましたところ、5箇所の領域を見つけることができました(図1)。その領域の前半3領域をフォワードプライマー、後半2領域をリバースプライマーとしてPCR反応を実施しましたところ、いずれの組み合わせでもAATを効率よく検出できることが分かりました(図2)。そこで、より簡易化を図るために、これらの領域をLAMP法へ応用してみました。まず、これらの領域をもとに支援ソフトを用いてLAMPプライマーセットを設計し、 Alicyclobacillus 属細菌由来DNAを用いてLAMP反応を行ってみました。その結果、AAT用LAMPプライマーセットはAATのみに反応し、容易にAATを鑑別することができることが分かりました(図3)(第25回日本食品微生物学会および2006年度日本食品微生物学会誌(in press)にて報告)。 |
|
 |
|
| 【 図 1 gyrB 遺伝子上のプライマー領域 】 | |
| さらに私たちは、 AAT以外の菌種についても特異領域の検索を行い、よく果汁から検出される A. acidocaldarius やグアイアコールを生産する A. acidiphilus などについてPCRプライマーセット(図4)(2005年日本農芸化学会大会にて報告)、およびそれらを応用したLAMPプライマーセット(第26回日本食品微生物学会にて報告)を構築することができました。 一連の開発により、 Alicyclobacillus 属細菌鑑別用の PCRおよびLAMPプライマーセットが提供されることとなりましたが、食品工場の現場で使用頂くために、現状の検査法との組み合わせの事例や、期間短縮につながる検査フローを、感度が優れているLAMP法に着目して提供していきたいと考えています。 |
|
 |
|
| 【 図 2 PCR反応産物の電気泳動の結果 】 | |
| (注)左端のマーカーを除き、いずれも AAT特異領域をプライマーにしたPCR反応産物を示す。左の数字はマーカーのバンド長、右の数字はPCR産物のバンド長を示す。 | |
 |
|
| 【 図 3 LAMP反応産物の電気泳動の結果(A)およびUV照射下での反応産物の観察結果(B) 】 | |
| (注) No.2-5:AAT、No.6-15:その他の Alicyclobacillus 属細菌、No.16:陽性コントロール、No.17:陰性コントロールを示す。本図は日本食品微生物学会誌から引用(後藤ら, 2006, in press) | |
 |
|
| 【 図 4 各種 Alicyclobacillus 属細菌特異プライマーを用いたPCR反応産物の電気泳動の結果 】 |