|
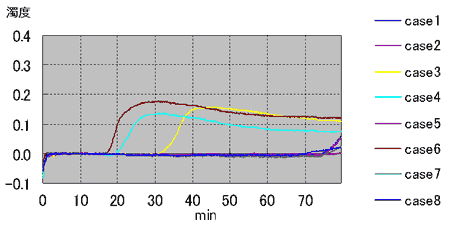
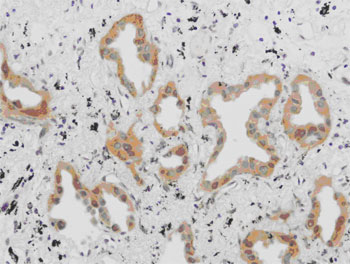
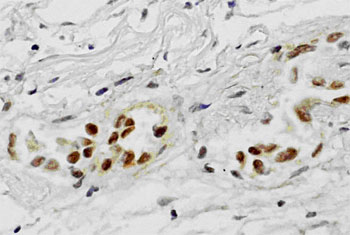
がんの手術において完全に腫瘍が切除されたと思われた例の中にも、不幸にもフォローアップの間に再発が確認される例は少なくない。このことは手術時に切除されたはずの腫瘍が体内にごく微量残存し、これが後に再発巣を形成していくことを示唆している。様々な癌の手術において、手術中の胸腔や腹腔にある体腔液中の癌細胞の存在は、播種と同様予後を悪くさせる因子として認識されつつある。特に胃癌では腹水または腹腔洗浄液中の癌細胞の細胞診検査を行うように癌取り扱い規約にも明記されている。肺癌でも手術時に胸腔を洗浄しその液中の癌細胞を細胞診で調べると、陽性の例では再発が有意に多く、その予後に影響していることは報告されている。しかし、従来から行われている細胞診検査では、スメア上の癌細胞が少数である、異型が弱く癌細胞と認識することが困難であるなどの理由で感度がとても悪く、客観性に問題がある。ましてこれを、術中迅速的に診断するとなれば、その検査精度はさらに低下することが考えられる。さらに、この検査が行えるのは細胞検査士という免許を取得している限られた検査技師のみでありどの病院にも常時充分確保されているわけではない。その細胞検査士にしても経験年数などにより細胞を判定する能力には差があり、再現性にも非常に問題がある。これらのことは今後体腔内の癌細胞の有無を検査する需要が高まる上で障害である。 我々はこのことに対し細胞診以外の客観的で、なおかつ迅速に結果が得られる方法を細胞診検査を補う目的で実施すべきと考えた。手術時に微量残存している腫瘍細胞を細胞診よりも客観的に高感度に検出することが出来れば、その後再発転移を起こしてくる症例を正確に予知できる可能性があり、さらにこれらを術中に迅速的に診断できれば追加処置も可能となり、患者の予後を改善できる可能性もある。術中に迅速的に診断できる遺伝子増幅法として LAMP ( Loop - mediated Isothermal Amplification ) 法が最近報告された 。最近の研究では RT-LAMP 法を用いて消化器癌の所属リンパ節の転移の有無を迅速に診断する方法が報告され、その有用性が認められつつある。 今回の研究では、迅速的に遺伝子診断できるこの RT-LAMP 法を使用して、術中に体腔内を洗浄した洗浄液中の微量な癌細胞を術中時間内に検出できるシステムを構築すべく検討を行った。 対象は当院において摘出手術が行われた 57 例の連続の肺腺癌の症例である。この摘出術の際、滅菌生理食塩水にて胸腔内を洗浄し、その回収した液よりm RNA の抽出を行った。基礎検討で 9 の因子を検討した結果、 MMP-7 と CEA が適した因子として選定され、このm RNA をターゲットに RT-LAMP 法を行った(図 1 )。 対象の腫瘍組織についてMMP -7 、 CEA の発現を調べたところ両方とも陰性だった例は 1 例のみであった。開胸時の胸腔洗浄液では、 MMP-7 が 55 例中 16 例( 29 %)で陽性であり、 CEA では 44 例中 6 例( 14 %)で陽性であった。特に、 MMP-7 の陽性例では胸膜浸潤と MMP-7 の検出は有意な相関が見られることが分かり( P=0.031 )、そのほかではリンパ節転移陽性例や中〜低分化の症例で MMP-7 が多く検出される傾向にあることがわかった。同時に行った細胞診検査では 2 例の開胸時洗浄液が陽性と判定されており、この例はRT - LAMP法でも陽性となった。この検出はサンプリングから判定まで約 1 時間であり術中に対応可能で、その迅速性、簡便性より有用性が高く、細胞診検査を補ううえで客観性と感度を高めると思われた。 われわれはさらにMMP -7 が癌細胞に発現していることを確認するために、mRNAを抽出した場所と同じ場所の組織を直ちにホルマリン固定し、これに対し免疫染色を行った。免疫染色は通常の方法で行い、その結果 MMP-7 は主に腫瘍細胞の細胞質に発現していた。免疫染色では 59 %の症例で MMP-7 の発現が確認された。免疫染色陽性例はすべて RT-LAMP 陽性例であった。われわれは次に、 LAMP の試薬に FITC をつけたd UTP を添加し、組織切片上で MMP-7 m RNA の発現を見る in situ RT-LAMP 法を検討した。その結果、正常部での MMP-7 の発現はほとんどなく、陽性コントロールとしてのβアクチンには反応があり、その状態で腫瘍組織中の MMP-7 を可視化することができた(図 2 )。 in situ RT-LAMP 法では 72 %で陽性反応が確認され、同じ切片を用いた免疫染色の結果とは強い相関が得られた(p= 0.0009 )。 LAMP 法は 6 つのプライマーを使うため特異性、感度が高いが、これを in situ に利用する場合さらに、他の遺伝子増幅法に比べ増幅産物が大きな分子となり洗浄操作で流出しにくい、恒温で反応が進行するため特別な in situ PCR 用のサーマルサイクラーを必要としないなどの利点が予想される。日常診断において使用する組織切片を用いてその点変異などの遺伝子異常を切片上で検出できれば、病理診断学に大きく貢献できる可能性がある。われわれは in situ LAMP を用いてさまざまなターゲットに応用するべく更なる検討を行った。具体的には、点変異を検出するための PCR の変法である ARMS ( Amplification Refractory Mutation System )法を in situ LAMP 法に応用し、点変異の有無を切片上で表すことを目的に検討を行った。 肺癌治療薬 gefitinib の効果予測に有用な EGFR の主要変異の 1 つである exon21 の L858R を今回のターゲットとし、 2 種の培養細胞および手術摘出された 26 例のパラフィン切片について in situ LAMP を行った。その結果、 26 例中 12 例の一般的な PCR 法で L858R 変異が確認された例では、全例 in situ LAMP で腫瘍細胞の核に反応が見られた(図 3 )。残りの 14 例は変異なしと判定されていたが、 in situ LAMP ではこのうちの 3 例に反応があった。また、陽性の腫瘍近傍の異型の明らかでない上皮細胞にも反応する例があり、この変異が腫瘍化の初期から起きることが示唆された。組織切片上で遺伝子変異を検出する in situ LAMP 法は、病理診断と遺伝子診断をダイレクトに結合できる有用なツールと考えられる 。 In situ LAMP 法の検討はバクテリアの遺伝子を検出した MARUYAMA らの報告があるにすぎない。また、遺伝子変異の有無をパラフィン包埋された組織切片上で検出した報告は現在までほとんど見られない。今回の方法では、非特異と思われる反応もあり技術的にまだ改良が必要であるが、われわれは病理診断学上有用な方法と考え、他の遺伝子に関してもさらに検討して行く予定である。 |
|||
|